Innhold
Oppdrettslaks har fått mye negativ oppmerksomhet i media, først og fremst når det gjelder rømming og lakselus. Vi skal derfor se litt nærmere på disse to temaene og prøve å belyse problemene og mulige løsninger.
Er tradisjonell avl bærekraftig?
Begrepet bærekraftig er jo noe vi som planlegger avlsprogram har tatt på alvor lenge, fordi avlsprogrammet må selv være bærekraftig ved at seleksjonen må kunne opprettholdes lenge, i prinsippet i det uendelige. For å få til det må vi unngå innavl, siden innavl fører til økt grad av #homozygoti, altså tap av genetisk variasjon. Har vi ingen eller lite genetisk variasjon, kan vi heller ikke selektere eller forbedre populasjonen ytterligere; det er jo ikke lenger noen særlig forskjell på det beste og de middels gode individene. Å kontrollere og holde nede innavlen er derfor det viktigste vi kan gjøre for å holde avlsarbeidet bærekraftig i seg selv.
Som nevnt vil seleksjon for tilvekst i seg selv føre til domestisering og en mindre stresset fisk. Men det er nå enda mer fokus på å redusere stress mer direkte gjennom måling av stress og ved å ta dette inn i avlsmålet. Dette er viktig for stadig å bedre fiskevelferden. At dette også har positive effekter i form av bedre sykdomsresistens og overlevelse, bedre kvalitet og bedre fôrutnyttelse er selvsagt også et pluss.
Genredigering –
#avsnittet_kommer
Kan vi avle fram en mer bærekraftig oppdrettslaks?
Bærekraft blir oftest assosiert med å redusere netto karbonutslipp og bruk av ikke fornybare ressurser. Hovedutfordringen for lakseproduksjonen er her lang transport, både av fôr og ferdig produkt. Det eneste vi kan ta tak i vha. avlsarbeidet er å bedre fôrutnytting ytterligere. Denne er allerede god i forhold til mange andre husdyrproduksjoner, men det er alltid mulig å gjøre den enda bedre. #I beskrivelsen av avlsegenskaper ble det nevnt at lavere stressrespons hos fisken også er bra for fôrutnyttelsen, men det jobbes nå målrettet med å selektere enda mer effektivt for denne egenskapen. Utfordringen er selvsagt at det er vanskelig å måle fôrforbruk på enkeltfisk, men det er nå utviklet metoder som gjør at vi indirekte kan registrere dette vha. isotoper. Dette fôret er imidlertid dyrt å produsere, så alternative registreringsmetoder er fortsatt under utvikling.
Rømt oppdrettslaks – et problem
Har oppdrettsfisk andre «gener» enn villfisk?
All oppdrettslaks stammer fra norske elver, og det blir, etter denne forfatteren oppfatning, derfor feil å snakke om at de representerer noen form for genetisk forurensning, som indikerer at oppdrettslaksen har andre gener enn villaksen, slik noen avisoverskrifter, av til også vitenskapelige rapporter, synes å hevde. Selvsagt vil oppdrettslaksen etter hvert ha blitt så domestisert at den ikke vil klare seg godt i naturen, men ved den type seleksjon som gjøres i norske avlsprogram er det kun snakk om å endre genfrekvenser, ikke innføring av nye gen eller allel. Vi har ingen bevis for at det enda har oppstått noen nye mutasjoner i oppdrettslaks enn det som finnes i villaks, og de genetiske endringene vi har oppnådd i oppdrettslaksen skyldes utelukkende endringer i allelfrekvenser for gen som påvirker de egenskapene vi selekterer for. De fleste egenskapene er styrt av mange tusen gener, slik at selv en stor endring i allelfrekvensen for hvert av dem vil kun ha en liten effekt på egenskapen. Et unntak her er kjønnsmodning, der ett eller noen få gen synes å være avgjørende, men det ser foreløpig ikke ut til at dette representerer noen spesiell viktig påvirkning fra oppdrettslaks inn i villakspopulasjonene.

Da #Akvaforsk startet sitt avlsprogram på laks ble det samlet inn stamfisk fra totalt ca 40 elver i Norge. Innledningsvis ble mange av disse sammenlignet for ulike egenskaper, bla. tilvekst, dødelighet og smoltifisering (se tabell 1). Som vi ser, utgjør variasjonen som skyldes genetiske ulikheter mellom elver kun ca 5 % av den totale variasjonen. Det er derfor liten grunn til å hevde at de genetiske forskjellene mellom elver i seg selv gir grunnlag for det populære standpunktet: «Hver lakseelvstamme er helt unik». Riktignok kan morfologiske kjennetegn og ulikheter blant stammer forekomme, men sannsynligvis er disse styrt av relativt få gen og er neppe viktig for #fitness i seg selv. Et viktig unntak er alder ved kjønnsmodning, der de mindre elvene klart vil favorisere laks som ikke er for stor når den skal vandre tilbake til gyteplassen.
Tabell 1. Variasjon mellom elvestammer i % av all variasjon (mellom enkeltfisk uansett stamme).
| Dødelighet, egg | 3,4% |
| Dødelighet, yngel | 1,8% |
| Smoltifisering, 1 år | 3,3% |
| Vekt, 190 dager | 3,8% |
| Vekt, 3 år | 7,4% |
| Markørgener | 6,5% |
En annen misoppfatning som ser ut til å være utbredt er at oppdrettsfisk er mer innavlet enn villfisk. Dette er også feil, fordi alle avlsprogram følger nøye med på innavlen i sine populasjoner. #Innavlsøkning per generasjon bør ikke overstige 0,5 % for at vi skal være sikre på at vi ikke reduserer den genetiske variasjonen i det lange løp. Det er sannsynlig at innavlsøkningen er mye større enn dette i de fleste lakseelvene, fordi det her ikke er «innavlskontroll», bortsett fra at feromoner kanskje vil være med på å hindre at nært beslektede individer parer seg med hverandre. Dette er sannsynligvis også årsaken til at så mye som 10 % av villfisken ikke vandrer opp i den elven der de vokste opp, men i andre elver, og på den måten er med på å holde oppe en god genetisk variasjon i de fleste elvene.
Oppdrettsfisken blir mindre og mindre «vill»
Oppdrettslaks vil derfor i stor grad fortsatt ha alleler som til en viss grad også kan fungere i naturen (figur 2). Den store reproduksjonsevnen til laks gjør at det vil lages store fullsøskengrupper som på en måte bretter ut et den genetiske variasjonen på ny for hver ny generasjon som lages. Når vi da også husker at halvparten av den genetiske variasjonen som er i en populasjon blir uttrykt som innen-familievariasjon, er det realistisk å regne med at i hvert fall noen få av avkommene vil ha en gensammensetning som gjør dem i stand til å overleve, selv i en lakseelv. Noen få oppdrettslaks vil derfor ikke nødvendigvis være en totalkatastrofe for den lokale laksestammen, men noen få individer vil kunne overleve og kanskje til og med bidra til økt genetisk variasjon og #fitness, etter at naturlig seleksjon har reversert effekten av domestiseringen som har skjedd i avlsarbeidet.

Men, det er likevel slik at seleksjon vil føre til #endringer i allelfrekvenser. Dette betyr at i det lange løp vil oppdrettsfisk bli så ulik villaks at for enkelte egenskaper vil allelfrekvensen ha blitt så ugunstig at selv den minste innblanding vil være skadelig for villaksstammen. Negative konsekvenser av rømt oppdrettsfisk i elvene er allerede dokumentert. Én negativ følge er at oppdrettslaks har en tendens til senere oppgang i elvene og dermed ankommer de gyteplassene etter at villfisken er ferdig med sin gyting. De vil da kunne ødelegger de gytegropene som allerede er laget og dermed også ødelegge mange villaksegg. Etter hvert som den genetiske avstanden til villaks blir større og større vil innblanding av oppdrettslaks selvsagt også være skadelig rent genetisk og føre til at villakspopulasjonen som helhet er dårligere tilpasset de naturlige forholdene i elva. Særlig vil dette kunne gjelde for egenskapen tidlig kjønnsmodning, der stamme-effekten kan være betydelig.
Genredigering – valg og dilemma
Genetisk modifisert organismer (GMO) er organismer som har fått sitt genom endret i laboratoriet for å forbedre eller endre en egenskap eller biologiske produkter. I konvensjonell husdyravl og planteavl har det lenge vært praksis å selektere utvalgte foreldre av en art for å produsere avkom som har ønskede egenskaper. Ved genetisk modifisering derimot, benyttes #rekombinante genteknologier for å produsere organismer med gener som har blitt endret på molekylært nivå, enten ved inkludering av gener fra den samme eller andre arter, eller som en har gjort lenge i planteavl, ved å kunstig frembringe mange nye mutasjoner og deretter velge ut de gunstigste variantene. Dette blir vanligvis gjort for å gjøre endringer i en egenskap som ikke er mulig, eller vil ta svært lang tid, med konvensjonelle avlsmetoder.

Et transgen er et gen som har blitt overført ved hjelp av ulike genetiske lab-teknikker fra en organisme til en annen. Dette fremmede DNA-segmentet kan enten beholde evnen til å produsere RNA eller protein i den transgene organismen, eller endre den normale funksjonen til den genetiske koden i denne organismen.
Konstruksjonen av et transgen krever sammensetning av noen hoveddeler. Transgenet må inneholde en promoter, som er en regulatorisk sekvens som vil bestemme hvor og når transgenet er aktivt, et ekson, som er protein-kodingssekvensen (kan f.eks avledes fra cDNA for det ønskede proteinet), og en stoppsekvens. Disse er vanligvis kombinert i et bakterielt plasmid, og kodingssekvensene eller transgenet har vanligvis kjent funksjon. Med tidligere, ofte kalt konvensjonelle, genmodifiseringsteknikker har en liten kontroll på hvor i genomet det transgenet vil inkorporeres. Dette gjør at det ofte må et betydelig antall forsøk til før man får en GMO som fungerer etter planen. På dyr vil dette selvsagt ha betydelige velferdsproblemer heftet med seg i utviklingsfasen.
Transgene planter, som mais og soyabønner, er tatt i bruk i noen land, f.eks. USA, mens disse plantene ikke er tillatt brukt i Norge. EU har også en veldig restriktiv GMO-lovgivning, men har tillatt dyrking av noen GMO-varianter av mais som er resistent mot skadedyr og sprøytemidler. Disse lovene er nå under revisjon, og det pågår en viss faglig og politisk tautrekking om utfallet. Det er generelt større skepsis blant vanlige forbrukere på å ta i bruk slike ny teknologier, mens et flertall av forskere ønsker å ta dem i bruk.
Nyere genredigeringsmetoder kan gjøre mer målrettete endring av gen enn de som er beskrevet over. Ofte brukes begrepet GE-organismer om disse (Gen-Editerte) for å skille de fra tradisjonelle GMO-er. Med disse nye teknikkene er mange forskjellige typer endringer mulig, dvs. både «knock-out» (slå av et gen), reparasjon og innsetting av nye gener. Figur 4 viser den såkalte CRISPR- Cas9-metoden, som er mest brukt (CRISPR: Clustered Regularly Interspaced Short Palindromic Repeats). Sentralt i denne metoden er enzymet Cas9 (det finnes også mange alternative varianter som Cas5, Csn1 eller Csx12), et naturlig forekommende protein som spiller en vital rolle i immunforsvaret til visse bakterier der det kutter DNA-et til DNA-virus eller plasmider som forsøker å infisere bakterien.
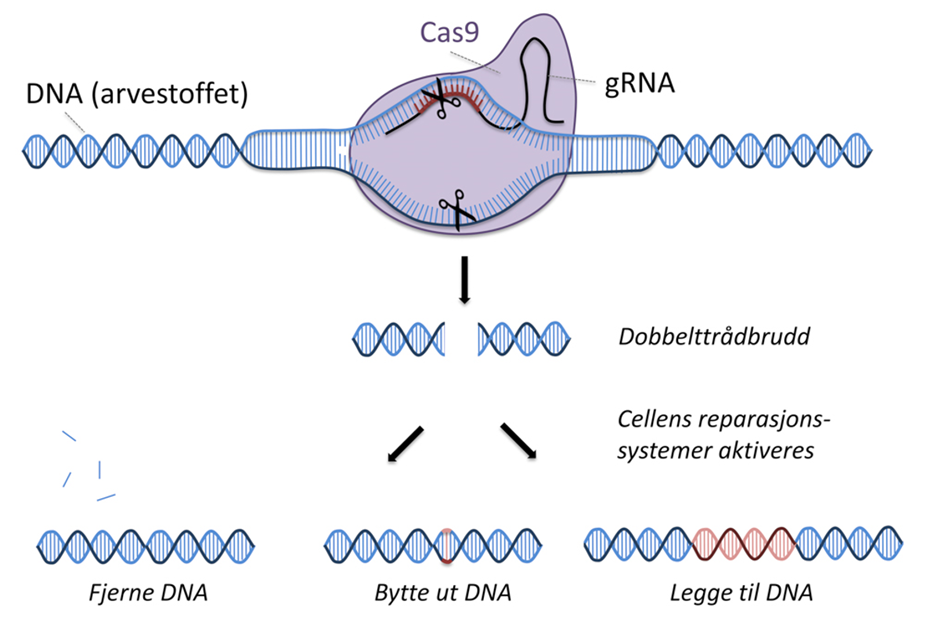
Av Sigrid Thoresen/Bioteknologirådet.
Andre alternative metoder for genredigering er TALEN (Transcription activator-like effector nucleases) og Zinkfinger-nuklease (ZFN). Disse metodene baserer seg på design og syntetisering av et tilpasset protein for hvert ønsket DNA-brudd, har høy presisjon, men er vanskeligere og mer tidkrevende enn å designe veiledende RNA (gRNA) som kreves for CRISPR. CRISPR kan også gjøre målrettede endringer på flere DNA-steder samtidig ved å bare introdusere forskjellige gRNA-er i miksen som brukes. I tillegg er kostnadene ved å bruke CRISPR relativt lave.

